Diketahui reaksi sel: Cu2+(aq) + 2e- → Cu(s) E0 = +0,34 volt Zn2+(aq) + 2e- → Zn(s) E0 = -0,76 volt Bila kedua logam
Diketahui reaksi sel:
Cu2+(aq) + 2e- → Cu(s) E0 = +0,34 volt
Zn2+(aq) + 2e- → Zn(s) E0 = -0,76 volt
Bila kedua logam tersebut dipasangkan untuk membentuk sel Volta, pernyataan berikut yang tidak benar adalah ….
A. Elektrode Zn teroksidasi dan elektrode Cu tereduksi.
B. Elektrode Zn sebagai anode dan Cu sebagai katode.
C. Potensial sel yang dihasilkan adalah 1,10 volt.
D. Notasi selnya: Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu(aq) E0sel = 1,10 V
E. Dalam sistem sel Volta tersebut elektron bergerak dari Cu menuju Zn.
Pembahasan:
Logam yang memiliki E0 lebih kecil selalu merupakan anode (mengalami oksidasi), berarti yang termasuk anode adalah Zn (E0 = -0,76 V) karena memiliki E0 yang lebih kecil daripada Cu (E0 = +0,34 V).
Karena Zn sebagai anode maka mengalami oksidasi, sedangkan Cu sebagai katode mengalami reduksi.
Notasi sel Volta: anode | ion || ion | katode
Maka:
Kesimpulannya, pernyataan yang tidak benar adalah jawaban E.
Jawaban: E
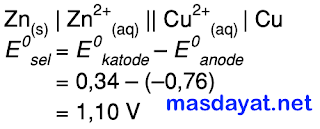
Post a Comment for "Diketahui reaksi sel: Cu2+(aq) + 2e- → Cu(s) E0 = +0,34 volt Zn2+(aq) + 2e- → Zn(s) E0 = -0,76 volt Bila kedua logam"